Le site d'étude est situé à la réserve de la Grande Sassière (45° 30' Nord, 7° Est ; Haute-Tarentaise, Savoie), sous l'autorité du Parc National de la Vanoise.
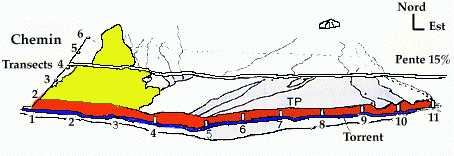
Figure 1. Domaine vital du groupe familial étudié.
TP : Terrier principal ; 1-6 : Transects longitudinaux ; 1-11 : carrés d'un mètre de côté.
Un groupe familial de 12 individus (deux adultes, quatre deux ans, deux un an et quatre marmottons), tous marqués, a été suivi pendant trois mois (juillet, août, septembre). Le groupe occupait un domaine vital de 4,5 hectares, à 2.340 mètres d'altitude, couvrant l'adret du torrent (Fig. 1). La pente moyenne de cette pelouse thermophile subalpine était de 15%. Elle est déneigée de début mai à début octobre. Le terrier principal se trouvait à proximité du talus du torrent (Massemin, 1992).
L'échantillonnage des espèces végétales du domaine vital a été entrepris le long de six transects longitudinaux. Leur taux de recouvrement est estimé dans 58 carrés d'un mètre de côté. Un spécimen de chaque espèce est récolté en vue d'établir un catalogue photographique de référence des épidermes des différents organes. Dix fèces sont collectées, la deuxième semaine de chaque mois, au niveau d'une latrine extérieure du groupe (Butet, 1985, 1987). Après préparation, les fragments non digérés sont examinés au microscope et comparés au catalogue de référence. Pour obtenir une distribution d'abondance significative des épidermes, une lecture de 400 fragments par échantillon mensuel a été réalisée (Massemin, 1992).
RESULTATS
Régime alimentaire
Le régime alimentaire est essentiellement herbivore. Dans les fèces se retrouvent, en moyenne sur les trois mois, des dicotylédones (88%) et des monocotylédones seulement pour 9%, mais les organes végétaux les plus fréquents sont les parties florales de dicotylédones (52%) ou les inflorescences de graminées (9%), les graines ne représentent qu'une très faible part (2 à 3%). Au cours des mois successifs, le pourcentage des graminées diminuent de 14% en juillet et août à 2% en septembre alors que celui des dicotylédones augmente (Fig. 2). La consommation des parties florales est significativement supérieure en juillet, alors que celle des parties végétatives et celle des graines le sont en août.
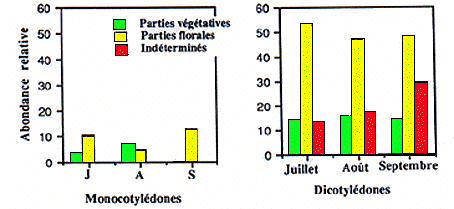
Figure 2. Variations mensuelles des organes végétaux consommés par la marmotte alpine.
Parmi les dicotylédones, les parties végétales d'Astragalus leontinus de Thymus et de Potentilla crantzii et les fleurs d'une plante non déterminée (C), d'Oxytropis gaudini, d'Helianthemum grandiflorum, de Pedicularis gyroflexa et de Crepis rhaetica ont été reconnues. Les fleurs non déterminées (C) et les feuilles d'Astragalus sont les plus consommées tout au long des trois mois. Par contre, la consommation des fleurs d'Helianthemum abondante en juillet diminue les autres mois pour âtre remplacée par celle d'Oxytropis (Fig. 3). En juillet, Helianthemum et Oxytropis sont en fleurs. A partir d'août, les fleurs d'Oxytropis persistent et les graines remplacent les fleurs d'Helianthemum.
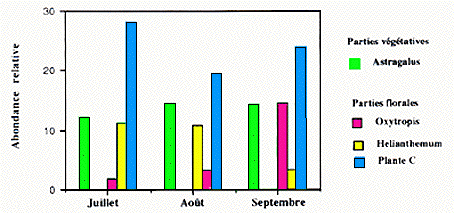 �
�
Figure 3. Variations mensuelles de quelques espèces végétales du régime alimentaire de la marmotte.
L'observation directe confirme la consommation d'Astragalus, de Potentilla, de Pedicularis et de Poacées. Des racines sont aussi consommées, mais n'ayant pas d'épiderme, aucune trace n'est reconnaissable dans les fèces. Au mois d'août et septembre, des orthoptères sont capturés. Au mois de septembre, le broutage de coeur de Carlina est observé (pas de traces dans les fèces).
Distribution des espèces végétales sur le domaine vital du groupe de marmottes
Cinquante six taxons ont été déterminés sur le domaine vital. Les plus abondants (présents dans plus de la moitié des carrés étudiés) sont les Poacées, et parmi les dicotylédones Erysimum pumilum, Sempervivum arachnoideum, Gentiana verna, Plantago alpina, Veronica allionii, Galium anisophyllum et Potentilla crantzii. Parmi ceux-ci , seules les Poacées et Potentilla crantzii sont consommées. Leur taux de recouvrement est compris entre 25 et 50%. Par contre, celui des autres dicotylédones consommées est faible (Crepis, Helianthemum, Oxytropis, Pedicularis, moins de 5%) ou très faible (Astragalus, Thymus). Deux espèces consommées de façon abondante (Astragalus et Oxytropis) sont en général éloignées du terrier principal. Par contre, les quatre autres espèces sont plus proches du terrier principal (Fig. 4).
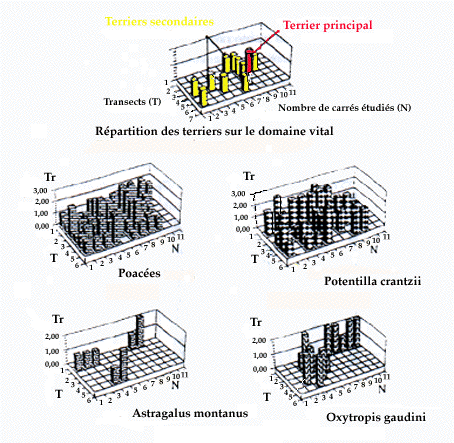
Figure 4. Taux de recouvrement (Tr) et répartition sur le domaine vital de quelques espèces consommées par la marmotte alpine.
DISCUSSION
Les marmottes étudiées préfèrent les plantes à fleurs (Fabacées : Astragalus, Oxytropis ; Cistacées : Helianthemum ; Scrofulariacées : Pedicularis ; Asteracées : Crepis ; Rosacées : Potentilla ; Lamiacées : Thymus) aux Poacées. La plupart de ces plantes ont une abondance relative faible, certaines d'entre elles sont éloignées du terrier principal (impliquant des déplacements importants ; Perrin et al., 1993). Il est possible que l'analyse des fèces ne reflète qu'imparfaitement le régime alimentaire. En effet, les épidermes des Dicotylédones seraient moins résistants à la digestion que ceux des graminées. En particulier, les épidermes de Potentilla et de Taraxacum se retrouveraient difficilement dans les fèces de Marmota flaviventris (Frase & Armitage, 1989). Nos résultats sous-estimeraient leur présence et l'importance des Dicotylédones. Le régime, basé sur neuf ou dix types de plantes, est peu diversifié pour un animal occupant un milieu végétal riche. Une telle sélectivité alimentaire, avec une préférence pour les parties florales de Dicotylédones, se retrouve chez Marmota caligata (Hansen, 1975) et chez Marmota flaviventris de Californie (Carey, 1985). Chez Marmota flaviventris du Colorado, les Dicotylédones négligées en début de saison, deviennent prépondérantes en cours de saison (Frase & Armitage, 1989).
La sélectivité alimentaire est affectée par la phénologie et la palatabilité des plantes. La consommation des fleurs s'accroît avec la floraison (à partir de juillet) et celle des graines en août. La sélection de plantes ou d'organes à forte valeur nutritive est fréquente chez les herbivores. En particulier, le contenu protéique, le contenu en eau et la digestibilité des Poacées diminuent avec leur maturation (Frase & Armitage, 1989). Les Dicotylédones sont plus riches en nutriments (particulièrement en phosphore, sodium et calcium) que les Poacées. Les légumineuses sont plus riches en azote et possèdent un fort taux minéral par rapport aux Poacées (Carey, 1985). Aussi, l'augmentation de la consommation des fleurs et des fleurs de légumineuses (Oxytropis) observée représente probablement un moyen de satisfaire les besoins des marmottes. Cependant, les graminées par leur abondance et leur absence de défenses chimiques anti-herbivores constituent une source d'énergie aisément disponible, ce qui explique leur consommation.
Par ailleurs, si la diversité végétale des pelouses alpines va en diminuant avec l'élévation de l'altitude, une mâme espèce végétale est à la fois plus riche en éléments nutritifs et de digestion plus facile, la lignification étant retardée (Guicherd, 1930) et constitue un aliment plus appétent. Les marmottes par leur consommation sélective d'espèces végétales palatables ont un impact non négligeable sur les pelouses alpines qu'elles modèlent (Del Moral, 1984).
BIBLIOGRAPHIE
Armitage K.B. (1979). Food selectivity by yellow-bellied marmots. J. Mammal., 60 (3 ): 628-629.
Barash D.P. (1989). Marmots. Social behavior and ecology. Stanford University Press, Stanford, p. 361.
Belovsky G.E. (1978). Diet optimization in a generalist herbivore: the moose. Theor. Pop. Biol., 14 : 105-134.
Bibikov D.I. (1989). Surki. Agropromizadat, Moscow, pp 253.
Butet A. (1985). Méthode d'étude du régime alimentaire d'un rongeur polyphage (Apodemus sylvaticus L., 1758) par l'analyse microscopique des fèces. Mammalia, 49 (4) : 456-483.
Butet A. (1987). L'analyse microscopique des fèces : une technique non perturbante d'étude des régimes alimentaires des mammifères phytophages. Arvicola, 4 (1) : 32-37.
Carey H.V. - (1985). Nutritional ecology of yellow-bellied marmots in the white mountains of California. Holarc. Ecol., 8 : 259-264.
Chapuis J.L. (1980). Méthodes d'étude du régime alimentaire du lapin de garenne, Oryctolagus cuniculus L. par l'analyse micrographique des fèces. Rev. Ecol. (Terre Vie), 34 : 161-198.
Del Moral R. (1984). The impact of the Olympic marmot on subalpine vegetation structure. Am. j. bot., 71 (9) : 1228-1236.
Fall M.W. (1971). Seasonal variations in the food consumption of woodchucks (Marmota monax). J. Mammal., 52 : 370-375.
Frase B.A., Armitage K.B. (1984). Foraging patterns of yellow-bellied marmots : role of kinship and individual variability. Behav. ecol., Sociobiol., 16 (1) : 1-10.
Frase B.A., Armitage K.B. (1989). Yellow-bellied marmots are generalist herbivores. Ethology, Ecology & Evolution, 1 : 353-366.
Guicherd J. (1930). Les alpages de la Savoie. L'agriculture du département de la Savoie. Bernigard & Privat, 76-79.
Hansen K.M. (1975). Foods of the hoary marmot on Kenai Peninsula, Alaska. Amer. Midl. Naturalist, 94 : 342-353.
Holmes W.G. (1984). Predation risk and foraging behavior of the hoary marmot in Alaska. Behav., ecol., sociobiol., 15 (4) : 293-301.
Kapitonov V.I. (1961). The significance of animal food and water in the life of Marmota camtschatica in the Kharaulakh mountains. Trudy Sredneaz. Nauch.-Issledovatel. Protivochum. Inst., 7 : 267-272.
Kilgore D.L.Jr, Armitage K.B. (1978). Energetics of yellow-bellied marmot populations. Ecology, 59 (1) : 78-88.
Kizilov V.A., Semenova N.L. (1961). The nutritional status of Marmota caudata (Rodentia). Trudy Sredneaz. Nauch.-Issledovatel. Protivochum. Inst., 7 : 261-265.
Massemin S. (1992). L'alimentation de la marmotte alpine (Marmota marmota) : échantillonnage botanique, étude coprologique et approche du comportement de vigilance. Rapport DEA, Adaptation et survie en environnements extrâmes, Lyon.
Perrin C., D. Allainé, M. Le Berre (1993). Socio-spatial organisation and activity distribution of the Alpine marmot Marmota marmota: Preliminary results. Ethology, 93 : 21-30.
Swihart R.K. (1990). Common components of orchard ground cover selected as food by captive woodchucks. J. Wildl. Manage., 54 (3) : 412-417.
Remerciements
Ce travail a été réalisé grâce au soutien financier du Ministère Français de l'Environnement (Contrat EGPN) et du Ministère de la Recherche (contrat CNRS, Programme Environnement). Il a pu se dérouler grâce au soutien actif de l'administration et des agents du Parc National de la Vanoise, que nous tenons à remercier.
A suivre...
retour ou sommaire