Marie-Pierre Callait
Laboratoire départemental d'analyses vétérinaires, Chambéry
RĂ©sumĂ© : La structure des systèmes hĂ´tes-parasites et les diffĂ©rents niveaux de distributions des parasites dans la population-hĂ´te pendant la fin de la pĂ©riode d’activitĂ© de la marmotte alpine, phase maximale de l’intensitĂ© parasitaire ont Ă©tĂ© examinĂ©s. Les helminthes ont Ă©tĂ© recherchĂ©s chez vingt-deux marmottes provenant du mĂŞme site. Des trois principales espèces parasites observĂ©es, Ctenotaenia marmotae prĂ©sente la prĂ©valence, l’abondance et l’intensitĂ© moyenne les plus Ă©levĂ©es, Citellina alpina, les plus faibles, et Ascaris laevis a des valeurs intermĂ©diaires. Par contre, si ces trois espèces prĂ©sentent un Ă©tat d’agrĂ©gation , celui-ci est très Ă©levĂ© chez Citellina et diminue chez Ascaris puis Ctenotaenia. Les stratĂ©gies d’infestation, de transmission et de survie sont discutĂ©es en tenant compte des caractĂ©ristiques des espèces-parasites et de l’espèce-hĂ´te. Elles traduisent les phĂ©nomènes de co-Ă©volution très poussĂ©s qui unissent parasites et hĂ´te. Mots clĂ©s : Marmota marmota, systèmes hĂ´tes-parasites, helminthes, dynamique parasitaire, Savoie.
Abstract: Distribution of the parasite infrapopulations in the Alpine marmot.
Helminth-marmot systems and the distribution of the parasites in an host population were studied at the end of summer, phase of maximum parasite intensity. Parasitic surveys of twenty two marmotsprincipales at the end of summer, phase of maximum parasite intensity. Parasitic surveCtenotaenia marmotaeysCitellina alpina, Ascaris laevis of twenty two marmotse and average intensity were highest in Ctenotaenia , lowest in Citellina and intermediate in Ascaris. But all the species had high level organisation with over-dispersed patterns of distribution, decreasing from. Citellina to Ctenotaenia. Infestation, transmission and survival strategies, depending on the characteristics parasite-species and host-species, were discussed in relation with co-evolution phenomenon.Key-words : Marmota marmota, host-parasit systems, helminths, parasitic dynamics, Savoy, France.
Pour chaque espèce parasite, la description de la distribution individus-parasites dans les individus-hĂ´tes est essentielle dans l’Ă©tude des phĂ©nomènes densitĂ©-dĂ©pendants qui ont lieu au niveau de la population parasite (Poulin 1993). La distribution des parasites parmi les hĂ´tes est utilisĂ©e comme base de l’Ă©valuation quantitative de la nature du parasitisme (Crofton 1971a). Il est donc indispensable de pouvoir distinguer les distributions observĂ©es et de les relier Ă des distributions thĂ©oriques connues, qui pourront servir de modèle pour comprendre les mĂ©canismes qui les dirigent. La distribution de trois espèces d’helminthes a Ă©tĂ© Ă©tudiĂ©e chez un Ă©chantillon de marmottes alpines sur le site de Bonneval-sur-Arc (Savoie) pendant la saison de chasse.
1. Objectifs et méthodes
Nous disposons des rĂ©sultats de 22 bilans parasitaires, issus de l’examen, soit de cadavres entiers, soit uniquement de viscères. Seuls les helminthes ont Ă©tĂ© recherchĂ©s dans cette partie de l’Ă©tude. L’Ă©chantillon provient d’animaux tuĂ©s Ă la chasse sur le site de Bonneval-sur-Arc, au cours des mois de septembre et d’octobre 1996 et 1997. Leur statut social au sein de la colonie n’est pas connu.
Les index Ă©pidĂ©miologiques (prĂ©valence, abondance, intensitĂ© moyenne) sont calculĂ©s pour chaque infrapopulation parasite Ă partir des rĂ©sultats de l’Ă©chantillon entier.
Le test de Normalité de Kolgomorov-Smirnov (probabilités de Lilliefors) est appliqué aux données observées pour déterminer la nature des tests statistiques à utiliser par la suite (paramétriques ou non-paramétriques). Le logiciel utilisé pour les calculs statistiques est STATISTICA version 5 (StatSoft).
Il est possible de caractĂ©riser le mode de dispersion des organismes par des distributions statistiques pour des variables biologiques discontinues (Combes 1995, Frontier & Pichon-Viale 1998) : elles sont agrĂ©gĂ©es ("concentration" des parasites dans certains individus-hĂ´tes, au dĂ©triment d’autres), " poissonniennes " (rĂ©partition au hasard) ou rĂ©gulières (rĂ©partition identique chez tous les individus-hĂ´tes). L’agrĂ©gation est très rĂ©pandue en Ă©cologie parasitaire (Combes 1995, Crofton 1971a et b).
La distribution de frĂ©quences du nombre de parasites par hĂ´te illustre quelle proportion de la population-hĂ´te porte un nombre donnĂ© de parasites. De plus, plusieurs indices peuvent ĂŞtre calculĂ©s pour caractĂ©riser la tendance d’une distribution observĂ©e et en particulier le niveau d’agrĂ©gation.
Si R est voisin de 1, la distribution est " poissonnienne " (variance Ă©gale Ă la moyenne) ; s’il est infĂ©rieur Ă 1, elle est rĂ©gulière ; s’il est supĂ©rieur Ă 1, elle est agrĂ©gĂ©e. Elle est d’autant plus agrĂ©gĂ©e que R est Ă©levĂ©. Il permet de plus de comparer des Ă©chantillons de prĂ©valence et d’abondance diffĂ©rentes.
Nous utiliserons l’estimateur du maximum de vraisemblance k3, car les conditions nĂ©cessaires au calcul des deux autres estimateurs ne sont remplies par aucune des distributions (Scherrer 1984). Cet estimateur k3 correspond Ă une Ă©quation itĂ©rative et ne nĂ©cessite pas de condition particulière :
![]() avec
avec ![]() = somme des fréquences observées des classes supérieures à yi.
= somme des fréquences observées des classes supérieures à yi.
k est une estimation indirecte de l’agrĂ©gation, car il est issu d’une distribution binomiale nĂ©gative thĂ©orique.
Le calcul de D, après simplification, est le suivant :

oĂą N = le nombre d’hĂ´tes dans l’Ă©chantillon ; xj = le nombre de parasites dans l’hĂ´te j (les hĂ´tes Ă©tant classĂ©s par ordre croissant de charge parasitaire) ; ![]() = le nombre moyen de parasites par hĂ´te.
= le nombre moyen de parasites par hĂ´te.
L’index a pour valeur minimale 0, quand la courbe observĂ©e correspond Ă la ligne droite hypothĂ©tique, et pour valeur maximale 1, quand tous les parasites sont portĂ©s par un seul hĂ´te (agrĂ©gation maximale). Dobson (1986) souligne qu’il faut toujours associer l’index D et l’histogramme de Lorenz correspondant. En effet, une valeur de l’index peut reprĂ©senter deux types de distributions : soit beaucoup d’hĂ´tes portent peu de parasites et beaucoup de parasites sont portĂ©s par peu d’hĂ´tes (cas le plus frĂ©quent), soit beaucoup d’hĂ´tes portent beaucoup de parasites et peu de parasites sont portĂ©s par peu d’hĂ´tes. La courbe de Lorenz correspondant au second cas est symĂ©trique de la première mais au-dessus de la ligne droite de distribution idĂ©ale.
La prĂ©cision de l’estimateur de l’agrĂ©gation augmente avec la taille de l’Ă©chantillon (Poulin 1996). Le degrĂ© d’agrĂ©gation ne dĂ©pend pas de la façon dont les hĂ´tes sont examinĂ©s, mais les hĂ´tes fortement infestĂ©s qui caractĂ©risent l’agrĂ©gation sont rares et n’apparaissent que dans les grands Ă©chantillons. Toutes les mesures de l’agrĂ©gation tendent Ă sous-estimer l’agrĂ©gation rĂ©elle du système hĂ´te-parasite Ă©tudiĂ© lorsque l’Ă©chantillon est rĂ©duit.
Nous chercherons Ă expliquer les patrons de distribution des parasites en fonction des particularitĂ©s des espèces-parasites (mode de transmission, prolificitĂ©, rĂ©sistance et distribution des formes de dissĂ©mination dans le milieu extĂ©rieur), des caractĂ©ristiques des espèces-hĂ´tes (individus : sexe, âge et statut social ; populations : organisation sociale et spatiale, nature et intensitĂ© des contacts, homogĂ©nĂ©itĂ© ou hĂ©tĂ©rogĂ©nĂ©itĂ© de l’occupation de l’espace) et des facteurs de l’environnement. Nous comparerons ici uniquement les distributions parasites en fonction du sexe et de l’âge de l’hĂ´te et en fonction des deux annĂ©es de prĂ©lèvement (test U de Mann-Whitney).
2. RĂ©sultats
2.1. Distibution de Ctenotaenia marmotae
La prĂ©valence observĂ©e pour cette espèce en fin de saison est maximale avec une abondance (Ă©gale, de ce fait, Ă l’intensitĂ© moyenne) très Ă©levĂ©e (tableau I). La prĂ©valence observĂ©e dans les Alpes italiennes au cours des mois de septembre et d’octobre (n = 7) est identique et l’abondance plus faible (33,6 + 51, Ă©tendue 3-149) mais pas significativement diffĂ©rente de celle de notre Ă©chantillon (Bassano et al. 1992). La comparaison avec d’autres donnĂ©es bibliographiques, sur la marmotte alpine ou d’autres espèces de marmottes, est rendue impossible par le fait que les auteurs ne distinguent pas dans leurs rĂ©sultats les valeurs obtenues Ă la fin de la saison d’activitĂ© des hĂ´tes.
La distribution des frĂ©quences du parasite et les trois index d’agrĂ©gation (tableau II, figures 1 et 2) montrent une surdispersion nette de la population parasite dans la population-hĂ´te. L’index D prĂ©sente pourtant une valeur assez faible (0,49), et la divergence entre la droite et la courbe formĂ©e par les barres d’histogramme n’est pas très forte (figure 2). Cependant du fait que la prĂ©valence est de 100 %, tous les hĂ´tes sont parasitĂ©s ; donc les parasites sont mieux rĂ©partis, quoique de façon très irrĂ©gulière, dans la population-hĂ´te que lorsque la prĂ©valence est plus faible. De plus, les individus-hĂ´tes qui hĂ©bergent un très grand nombre de parasites sont nombreux (23 % portent plus de 200 vers). Ce qui explique valeur Ă©levĂ©e de k : 1,083 .
Tableau I : Index Ă©pidĂ©miologiques parasitaires pour C. marmotae dans la population de marmottes de Bonneval-sur-Arc en fin d’Ă©tĂ© (n = 22)
|
Prévalence + I.C. |
Abondance M + E.T. |
Intensité moyenne M + E.T. |
Etendue |
|
100% + 4 |
96,4 + 96,3 |
96,4 + 96,3 |
1-309 |
I.C. = intervalle de confiance ; M = moyenne ; E.T. = écart-type.
Â
Tableau II : Indices d’agrĂ©gation parasitaire pour C. marmotae dans la population en fin d’Ă©tĂ© (n = 22 ).
|
Rapport Variance/Moyenne (R) |
Paramètre binomial. négatif (k3) |
Index de divergence (D) |
|
91,9 |
1,083 |
0,49 |
A cette pĂ©riode de l’annĂ©e, la majoritĂ© des vers identifiĂ©s (97,9 %) prĂ©sentait la caractĂ©ristique des individus adultes : extrĂ©mitĂ© caudale "carrĂ©e", traduisant la largeur des segments murs Ă©mis.
Du fait de la grande taille deC. marmotae, la biomasse parasitaire qui en dĂ©coule est très Ă©levĂ©e (86 grammes pour l’individu 44 qui hĂ©bergeait 206 C. marmotae, soit 2 % du poids corporel de ce mâle adulte de 4,4 kilogrammes, figure4). Les marmottes portent en moyenne une biomasse de 46,9 grammes de vers en fin de saison (soit un poids moyen pour un taenia de 0,4 gramme).

Figure 1 : Distribution de fréquences de Ctenotaenia marmotae
en fin d’Ă©tĂ© sur le site de Bonneval-sur-Arc.

Figure 2 : Diagramme de Lorenz des pourcentages cumulés de Ctenotaenia marmotae
en fin d’Ă©tĂ© (la ligne droite indique la distribution uniforme idĂ©ale)
Le coefficient de corrĂ©lation r2 entre nombre de vers et biomasse parasitaire (n = 19) est de 0,31 ; il atteint 0,56 pour le sous-Ă©chantillon ne comprenant que les valeurs infĂ©rieures Ă 200 vers/hĂ´te (n = 14) mais diminue Ă 0,12 pour l’autre partie (n = 5). La faiblesse de la corrĂ©lation au-dessus du seuil de 200 vers/hĂ´te, montre qu’une augmentation du nombre de vers prĂ©sents dans l’hĂ´te, si elle n’est pas liĂ©e Ă une augmentation correspondante de la biomasse, est due Ă une diminution de la taille des vers.
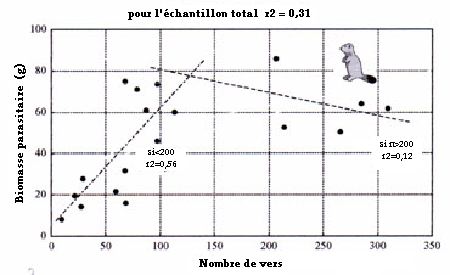
Figure 3Â : Biomasse parasitaire de Ctenotaenia marmotae en fonction du nombre de vers.
(avec les droites de rĂ©gression linĂ©aire correspondant aux deux parties de l’Ă©chantillon)
Ce phĂ©nomène, "effet de surpeuplement" (crowding effect), est Ă©tudiĂ© depuis longtemps pour les cestodes (Read 1951, Euzeby 1966). Il est caractĂ©risĂ© sur le plan morphologique par la diminution de la taille du nombre de vers, dont nous observons ici la consĂ©quence directe sur la biomasse parasitaire, et, sur le plan biologique, par un ralentissement de la croissance des cestodes Ă partir d’un certain seuil d’infestation. Le dĂ©lai d’acquisition de la maturitĂ© sexuelle n’est pas affectĂ© par ce phĂ©nomène, car il est indĂ©pendant de la vitesse de croissance des vers, mais le nombre de segments ovigères Ă©mis est considĂ©rablement rĂ©duit (Euzeby 1966).
Les valeurs de l’abondance et l’intensitĂ© moyenne observĂ©es suivant le sexe et l’âge de l’hĂ´te, et suivant les annĂ©es de prĂ©lèvement ne montrent aucune diffĂ©rence significative (Mann-Whitney).
Distribution d’Ascaris laevis
La prĂ©valence d’A. laevis est Ă©levĂ©e. L’abondance et l’intensitĂ© moyenne sont plus faibles que pour Ctenotaenia marmotae (tableauIII). Les index calculĂ©s Ă partir des donnĂ©es de Bassano et al. (1992) sont significativement infĂ©rieurs : prĂ©valence 28 %, abondance 3,6 + 7,2 et intensitĂ© moyenne 12,5 + 9,2.
La distribution observĂ©e diffère d’une distribution normale (Kolmogorov-Smirnov, d = 0,24 p < 0,01).
Tableau III : Index Ă©pidĂ©miologiques parasitaires pour Ascaris laevis dans la population de marmottes de Bonneval-sur-Arc en fin d’Ă©tĂ© (n = 22)
|
Prévalence + I.C. |
Abondanceo M + E.T. |
Intensité Moyenne M +E.T. |
ExtrĂŞmes |
|
86% + 14 |
45,1 + 60,4 |
52,2 + 62,2 |
0-258 |
Tableau IV : Indices d’agrĂ©gation parasitaire pour Ascaris laevis dans la population de Bonneval-sur-Arc en fin d’Ă©tĂ© (n = 22 ).
|
Rapport Variance/Moyenne (R) |
Paramètre binomial. négatif (k3) |
Index de divergence (D) |
|
77,3 |
0,786 |
0,56 |
Les trois index (tableau VI) et la figure 4 montrent une rĂ©elle agrĂ©gation de la population parasite dans la population-hĂ´te. L’index D est supĂ©rieur Ă celui de Ctenotaenia marmotae, et la divergence entre la droite et la courbe formĂ©e par les barres d’histogramme est plus grande (figure 5) ; de mĂŞme le paramètre k indique une agrĂ©gation plus forte Ă cause de la prĂ©sence de deux individus-hĂ´tes porteurs d’un nombre extrĂŞme de vers. Au contraire, le rapport R est plus faible pour A. laevis que pour C. marmotae, car la majoritĂ© des individus-hĂ´tes sont porteurs de moins de 80 vers.
Pour 6 individus-hĂ´tes le sexage des parasites a Ă©tĂ© rĂ©alisĂ©. La valeur du sex-ratio est de 0,37. Les femelles sont donc majoritaires en automne dans l’organisme-hĂ´te. De plus une grande partie d’entre elles est au stade adulte (prĂ©sence d’œufs, visibles par transparence dans le corps des individus).

Figure 4 : Distribution de frĂ©quence pour Ascaris laevis en fin d’Ă©tĂ© sur le site de Bonneval-sur-Arc.

Â
Figure 5 : Diagramme de Lorenz des pourcentages cumulĂ©s d’Ascaris laevis
en fin d’Ă©tĂ© (la ligne droite indique la distribution uniforme idĂ©ale).

Figure 6: Biomasse parasitaire d’Ascaris laevis en fonction du nombre de vers
Ascaris laevis est, comme Ctenotaenia marmotae, un parasite de grande taille Ă l’Ă©tat adulte. La biomasse parasitaire qu’il reprĂ©sente est parfois aussi impressionnante : 80,3 grammes pour l’individu (32) de 4 kilogrammes hĂ©bergeant 66 parasites. Portant aussi 73,6 grammes de C. marmotae, la charge parasitaire totale de cet individu s’Ă©levait donc Ă 3,9 % de son poids corporel ! Mais la figure 6 ne montre pas de relation linĂ©aire Ă©troite entre le nombre de vers et la biomasse corporelle (r2 = 0,2). Au contraire, mis Ă part deux cas extrĂŞmes, toutes les biomasses parasitaires sont groupĂ©es autour des mĂŞmes valeurs ( < 20 grammes), quel que soit le nombre de vers.
La comparaison des valeurs de l’abondance et de l’intensitĂ© moyenne observĂ©es suivant le sexe et l’âge de l’hĂ´te, et suivant les annĂ©es de prĂ©lèvement, test de Mann-Whitney, ne montre aucune diffĂ©rence significative pour toutes les combinaisons possibles. Au contraire, les mâles et les femelles prĂ©sentent des valeurs très proches d’abondance (p = 0,91) et d’intensitĂ© moyenne (p = 0,83).
Â
2.3. Distribution de Citellina alpina
La valeur de la prévalence obtenue pour Citellina alpina est plus faible que celle des deux espèces précédentes : elle atteint 67 % (tableau V). Le maximum de vers dénombrés a été de 230, alors que, dans la majorité des cas, on observe la présence de 5 à 25 parasites par hôte sur le site étudié (figure 7).
Tableau V : Index Ă©pidĂ©miologiques parasitaires pour Citellina alpina dans la population de marmottes de Bonneval-sur-Arc en fin d’Ă©tĂ© (n = 22)
|
Prévalence + I.C. |
Abondance M + E.T. |
Intensité Moyenne M + E.T. |
ExtrĂŞmes |
|
67% + 20 |
20,6 + 48,7 |
30,2 + 56,9 |
0-230 |
La distribution observĂ©e diffère d’une distribution Normale (Kolmogorov-Smirnov , d = 0,35 p < 0,01).
Les trois index d’agrĂ©gation (tableau VI) et la figure 7 illustrent la forte surdispersion de la population parasite dans la population-hĂ´te. L’index D prĂ©sente la valeur la plus Ă©levĂ©e, et la divergence entre la droite et la courbe formĂ©e par les barres d’histogramme est encore plus concave que dans les deux cas prĂ©cĂ©dents (figure 8). De mĂŞme, le rapport R est plus Ă©levĂ© et le paramètre k plus faible que pour Ascaris laevis et Ctenotaenia marmotae. Ce degrĂ© d’agrĂ©gation plus Ă©levĂ© est dĂ» Ă la prĂ©sence, d’une part d’une majoritĂ© d’individus porteurs de moins de 30 parasites et, d’autre part d’un seul individu prĂ©sentant un nombre de vers très supĂ©rieur aux autres. En effet 50 % des vers sont portĂ©s par 95 % des hĂ´tes (figure 8).
Tableau VI : Indices d’agrĂ©gation parasitaire pour Citellina alpina dans la population de Bonneval-sur-Arc en fin d’Ă©tĂ© (n = 22 ).
|
Rapport Variance/Moyenne (R) |
Paramètre binomial. négatif (k3) |
Index de divergence (D) |
|
109,9 |
0,492 |
0,73 |

Figure 7 : Distribution de frĂ©quence de Citellina alpina en fin d’Ă©tĂ©.

Figure 8 : Pourcentages cumulĂ©s de Citellina alpina en fin d’Ă©tĂ©
(la droite indique la distribution uniforme idéale).
Les vers adultes sont de petite taille (7 Ă 10 mm), donc la biomasse parasitaire qui dĂ©coule de leur prĂ©sence n’a pas Ă©tĂ© mesurĂ©e.
Dans tous les cas, le sexage des vers a montrĂ© une forte prĂ©dominance des mâles : le sex-ratio est de 0,88. Dans la majoritĂ© des infrapopulations, les parasites femelles prĂ©sents Ă©taient des formes immatures ; seul l’individu (53), qui prĂ©sentait la charge maximale en Citellina alpina Ă cette Ă©poque de l’annĂ©e, arborait presque autant de femelles matures que de femelles immatures.
Comme prĂ©cĂ©demment, aucun des tests U ne signale de diffĂ©rence significative entre les diffĂ©rentes sĂ©ries, sexe et âge de l’hĂ´te ainsi que l’annĂ©e de prĂ©lèvement.
Discussion : Causes et conséquences des distributions agrégées
Les distributions du nombre de parasites dans une population hĂ´te sont des " entitĂ©s dynamiques plutĂ´t que statiques, gĂ©nĂ©rĂ©es par des forces opposĂ©es, certaines agissant pour crĂ©er la sur-dispersion et d’autres pour engendrer la sous-dispersion " (Anderson & May 1979 ; Anderson & Gordon 1982 ; figure 9).
| Facteurs qui génèrent la sous-dispersion | Facteurs qui génèrent la sur-dispersion |
| 1. MortalitĂ© parasite | HĂ©tĂ©rogĂ©nĂ©itĂ© dans la sensibilitĂ© hĂ´te Ă l’infestation |
| 1. Processus densité-dépendants | 2. Structures spatiales et sociales de la population hôte |
| 3. Mortalité hôte induite par le parasite | 3. Hétérogénéité dans la capacité hôte à tuer les parasites par réponse immunologique ou autre |
| 4. Mode de transmission du parasite | |
| 5. Reproduction directe du parasite dans l’hĂ´te |
Figure 9 : Facteurs Ă l’origine de la dispersion des parasites (Anderson & Gordon 1982, modifiĂ©).
Cet aspect dynamique nous a fait choisir de dresser un "Ă©tat des lieux" de la distribution des parasites de la marmotte alpine sur un site dĂ©limitĂ© et dans un intervalle de temps rĂ©duit. Nous avons ainsi pu montrer un Ă©tat de sur-dispersion ou d’agrĂ©gation diffĂ©rent pour les trois espèces d’helminthes, Ctenotaenia marmotae, Ascaris laevis et Citellina alpina, dans un Ă©chantillon d’individus-hĂ´tes.
3.1. Origines de l’agrĂ©gation
Les processus Ă l’origine des patrons de dispersion des parasites sont liĂ©s Ă l’hĂ©tĂ©rogĂ©nĂ©itĂ© de la relation de la population-hĂ´te avec la population-parasite (Combes 1995). Les "causes" de l’agrĂ©gation peuvent ĂŞtre rangĂ©es dans deux catĂ©gories : celles qui dĂ©pendent du parasite et celles qui dĂ©pendent de l’hĂ´te. Dans chacune de ces catĂ©gories, se distinguent Ă nouveau deux types de mĂ©canismes : ceux liĂ©s Ă la rencontre hĂ´te/parasite et ceux liĂ©s au dĂ©veloppement et Ă la survie du parasite dans l’hĂ´te.
3.1.1. Facteurs liés aux parasites
Le mode de transmission du parasite est un élément déterminant de la rencontre avec ses hôtes potentiels. On distingue les parasites " contagieux ", à transmission directe (contact physique des hôtes entre eux ou avec leurs déjections) ou indirecte par le milieu (sans déplacement par un vecteur) et les parasites transmissibles (transmission par vecteur ; Cote & Poulin 1995, Fromont 1997).
Dans le groupe des parasites " contagieux ", certaines espèces, comme Ascaris laevis et Citellina alpina, prĂ©sentent un cycle direct (pas de stade dispersant). Le parasite ne peut donc pas aller Ă la rencontre de son hĂ´te. Pour augmenter ses "chances" de transmission, il doit augmenter le nombre de ses propagules Ă©mises dans les fèces de l’hĂ´te, puis dissĂ©minĂ©es dans le milieu extĂ©rieur ou sur le pelage de l’hĂ´te. Le parasite doit aussi augmenter leur capacitĂ© de rĂ©sistance dans le milieu extĂ©rieur. Ce mode de transmission favorise donc les parasites Ă longue durĂ©e de vie, Ă fĂ©conditĂ© Ă©levĂ©e et dont les propagules sont bien rĂ©sistantes dans l’environnement. Ces mĂ©canismes augmentent la densitĂ© des stades infestants de parasites dans le milieu extĂ©rieur après maturation. Les pertes au cours de la transmission sont Ă©normes. Chez le lagopède, un stade libre sur un million du parasite Trichotrongylus tenuis devient adulte (Dobson & Hudson 1992) ! D’autre part, le taux de rencontre entre les hĂ´tes Ă©ventuels et les stades infestants est fortement influencĂ© par la distribution spatiale de ces derniers (Keymer & Anderson 1979) : la distribution, elle-mĂŞme agrĂ©gĂ©e, des stades infestants dans le milieu extĂ©rieur peut permettre l’acquisition des parasites en "lots" plus ou moins grands (Combes 1995).
La biologie d’Ascaris laevis, avec une longĂ©vitĂ© probable de plusieurs mois et une bonne survie des œufs dans le milieu extĂ©rieur, en particulier dans la neige, explique donc en partie la sur-dispersion observĂ©e. De plus, la distribution des propagules dans le milieu est agrĂ©gĂ©e, car les fèces, qui les renferment, sont regroupĂ©es dans les nombreuses latrines externes dissĂ©minĂ©es sur chaque territoire.
Pour Citellina alpina, la rĂ©sistance des œufs est probablement de courte durĂ©e. Mais le manque de connaissances sur sa longĂ©vitĂ© et sa fĂ©conditĂ© ne permettent pas d’Ă©valuer l’efficacitĂ© de sa transmission et d’expliquer les mĂ©canismes de rencontre ainsi, que l’origine de l’agrĂ©gation observĂ©e.
Â
Dans le groupe des espèces transmissibles, les parasites, tels que Ctenotaenia marmotae, prĂ©sentent des cycles de vie indirects avec deux hĂ´tes (ou plus), en gĂ©nĂ©ral mobiles, pour complĂ©ter leur dĂ©veloppement. La transmission se fait par des liens de type "prĂ©dateur-proie" avec une phase d’infestation de l’hĂ´te-intermĂ©diaire (ingestion d’œufs prĂ©sents dans les fèces par les Oribates coprophages dans le cas de C. marmotae), suivie de la contamination de l’hĂ´te-dĂ©finitif (ingestion des Oribates infestants par les marmottes). Les contraintes imposĂ©es par ces liens "prĂ©dateur-proie" ne sont probablement pas dĂ©savantageuses pour la stabilitĂ© et la persistance des populations-parasites puisqu’elles sont frĂ©quentes dans les cycles de vie des helminthes (Keymer & Anderson 1979).
Enfin, l’infestation multiple des hĂ´tes-intermĂ©diaires conduit Ă l’infestation des hĂ´tes-dĂ©finitifs par "lots" : l’agrĂ©gation du parasite, dans le premier lot, participe Ă la crĂ©ation de l’agrĂ©gation dans le second. Par contre, alors qu’un parasite semble rare dans son hĂ´te intermĂ©diaire, une telle raretĂ© ne s’observe pas nĂ©cessairement chez l’hĂ´te dĂ©finitif (Hair 1975). Ainsi, chez Ctenotaenia marmotae,, sa prĂ©valence chez l’hĂ´te intermĂ©diaire est estimĂ©e Ă 0,4 % alors qu’elle est de 100 % chez l’hĂ´te dĂ©finitif en automne (Ebermann 1976). La combinaison de ces processus chez C. marmotae, explique l’infestation des individus examinĂ©s. L’efficacitĂ© des stratĂ©gies de transmission du parasite est Ă l’origine d’une dispersion moins forte des vers de cette espèce que l’agrĂ©gation montrĂ©e pour les deux autres helminthes.
Le phĂ©nomène de favorisation : processus Ă©thologique adaptatif modifiant les positions spatio-temporelles du parasite et de sa cible dans un sens qui augmente la probabilitĂ© de leur rencontre a Ă©tĂ© dĂ©fini par Combes (1991). Ainsi, les cystacanthes de l’acanthocĂ©phale Polymorphus paraxodus provoquent l’expression de comportements de l’amphipode hĂ´te-intermĂ©diaire qui augmentent significativement ses chances d’ĂŞtre ingĂ©rĂ©s par le canard hĂ´te-dĂ©finitif (Holmes & Bethel 1972). Un tel phĂ©nomène serait Ă rechercher chez les hĂ´tes intermĂ©diaires de Ctenotaenia marmotae pour expliquer l’Ă©cart de prĂ©valence observĂ© entre les deux hĂ´tes, intermĂ©diaire et dĂ©finitif. En fait, l’influence de la manipulation comportementale de l’hĂ´te par le parasite est probablement très sous-estimĂ©e (Thompson & Kavaliers 1994 , Combes 1995).
Une fois que le parasite a atteint son hĂ´te, il doit ĂŞtre capable de vivre et de se dĂ©velopper dans cet organisme jusqu’Ă sa reproduction sexuĂ©e dans l’hĂ´te dĂ©finitif, sa maturation ou sa multiplication asexuĂ©e dans l’hĂ´te intermĂ©diaire. Pour cela la sĂ©lection s’exerce au niveau des parasites, pour favoriser ceux qui possèdent la meilleure capacitĂ© Ă s’adapter Ă l’environnement hĂ´te, notamment Ă Ă©chapper Ă l’immunitĂ© de celui-ci (Combes 1995). Cette adaptation nĂ©cessaire conduit le parasite Ă rĂ©duire le nombre d’hĂ´tes dans lesquels il peut vivre : la restriction de la dimension hĂ´te de la niche Ă©cologique d’un parasite est la règle (Rhodes 1994, Combes 1995), mĂŞme si certaines espèces parasites sont capables de se dĂ©velopper, avec plus ou moins de succès, dans un grand nombre d’espèces hĂ´tes. Il peut ainsi arriver qu’un hĂ´te soit rĂ©ceptif Ă peu d’espèces de parasites, mais les hĂ©berge en abondance. Ainsi, chez deux espèces sympatriques de crabes, hĂ´tes intermĂ©diaires d’helminthes parasites : l’une possède une faune parasitaire riche mais très peu abondante, alors que l’autre prĂ©sente une communautĂ© parasitaire pauvre mais très abondante (Bush et al. 1993).
Parmi les trois helminthes de la communautĂ© parasitaire de la marmotte alpine, recensĂ©s en abondance sur le site de Bonneval-sur-Arc, Ctenotaenia marmotae et Ascaris laevis sont stĂ©noxènes et Citellina alpina oĂŻoxène. Leur abondance dans les autres populations ou espèces-hĂ´tes est rarement connue, Ă l’exception des Ă©tudes chez la marmotte alpine oĂą elles forment aussi la structure principale des communautĂ©s parasitaires observĂ©es (Sabatier 1989, Bassano et al., 1992, Manfredi et al., 1992, Preleuthner et al., 1996). La spĂ©cialisation des trois helminthes prĂ©sents dans les infracommunautĂ©s de marmottes alpines Ă©tudiĂ©es favorise l’agrĂ©gation dans le sens oĂą les formes infestantes ingĂ©rĂ©es, en quantitĂ©s variables, par la marmotte ont de bonnes chances de se dĂ©velopper dans leur hĂ´te dĂ©finitif.
3.1.2. Facteurs liĂ©s Ă l’hĂ´te
Certains individus-hĂ´tes peuvent offrir une meilleure "qualitĂ© d’habitat" que d’autres (Combes 1995), favorisant l’agrĂ©gation des individus-parasites. Ainsi, un habitat de bonne qualitĂ© pour un parasite est un hĂ´te que le parasite peut rencontrer facilement et avec lequel la compatibilitĂ© est possible.
La nature des contacts entre individus-hĂ´tes sains et infestĂ©s est dĂ©terminante pour la transmission du parasite Ă l’hĂ´te, en particulier pour les parasites contagieux. Les structures spatiale et sociale des populations-hĂ´tes sont donc susceptibles de favoriser ou non l’agrĂ©gation parasitaire.
Les structures spatiales sont les plus Ă©tudiĂ©es. Fromont (1997) distingue les populations homogènes, dans lesquelles tous les individus ont la mĂŞme probabilitĂ© de rencontre, et les populations hĂ©tĂ©rogènes, dans le cas contraire. Les colonies de marmottes prĂ©sentent des structures spatiales hautement hĂ©tĂ©rogènes : l’organisation en mĂ©tapopulations, ensemble de colonies interconnectĂ©es, correspond Ă un cas extrĂŞme d’hĂ©tĂ©rogĂ©nĂ©itĂ©. Au sein d’une colonie donnĂ©e, la rĂ©partition des marmottes en groupes familiaux, territoriaux est susceptible de favoriser la transmission des parasites, par rapport Ă une distribution rĂ©gulière (Blower & Roughgarden 1989 , Grosholz 1993). L’importance des charges parasitaires dĂ©nombrĂ©es montre que l’utilisation des mĂŞmes latrines par les membres du groupe, le toilettage mutuel, la cohabitation dans les mĂŞme terriers sont des sources de transmission parasitaire très efficaces. De plus, la taille des groupes, parfois importante chez la marmotte alpine (10 individus ou plus), peut accroĂ®tre encore le risque d’infestation. En effet, Cote & Poulin (1995) ont montrĂ© l’existence d’une corrĂ©lation positive entre la prĂ©valence du parasite et la taille du groupe hĂ´te, dans une mĂ©ta-analyse regroupant six Ă©tudes d’espèces sociales. Ils n’ont au contraire pas mis en Ă©vidence de relation entre charge parasitaire et taille du groupe, mĂŞme chez les espèces hĂ´tes sĂ©dentaires pour lesquelles on pouvait attendre une corrĂ©lation positive. L’absence de connaissances sur la composition des groupes d’oĂą sont issues les marmottes de Bonneval-sur-Arc ne nous permet pas d’Ă©tudier cet aspect.
Chez la marmotte la structure spatiale se mĂŞle Ă l’organisation sociale : les relations entre les individus dĂ©pendent de leur statut hiĂ©rarchique. Les interactions sociales, amicales ou agonistiques, entre individus, le choix du partenaire sexuel pour les individus dominants, favorisent les contacts. Ces relations peuvent donc influencer ou ĂŞtre influencĂ©es par le parasitisme.
L’Ă©tude de la relation entre les niveaux d’infestation par des ectoparasites et la socialitĂ©, en conditions naturelles, chez la marmotte alpine (Arnold & Lichtenstein 1993) comme chez la marmotte Ă ventre jaune (Van Vuren 1996) ne montre pas d’augmentation significative de la charge en ectoparasites avec la taille des groupes sociaux. Le nombre moyen d’Echinonyssus blanchardi, diffĂ©rent d’un groupe Ă l’autre, n’est pas corrĂ©lĂ© avec la densitĂ© de marmottes alpines sur un territoire donnĂ© (Arnold & Lichtenstein 1993). Les charges en ectoparasites des marmottes Ă ventre jaune ne sont pas plus Ă©levĂ©es chez les individus coloniaux que chez ceux qui ne le sont pas, ni plus Ă©levĂ©es chez les mâles polygynes (censĂ©s avoir plus de contacts avec les autres membres du groupe, en particulier avec les femelles) que chez les monogames (Van Vuren 1996). Ne connaissant pas la structure sociale des groupes d’origine de notre Ă©chantillon, nous ne pouvons apporter aucune information nouvelle concernant les relations entre le statut social des individus et la charge parasitaire pour chacun des helminthes recensĂ©s. De plus, il est très difficile de prĂ©dire dans quel sens peuvent se faire ces relations, puisque les deux hypothèses proposĂ©es par Combes (1995) " plus Ă©levĂ© le statut, moins abondant le parasite " et " plus Ă©levĂ© le statut, plus abondant le parasite " sont vĂ©rifiĂ©es tour Ă tour suivant les systèmes hĂ´te-parasite Ă©tudiĂ©s. Par exemple, une Ă©tude expĂ©rimentale montre que l’infestation des souris par le nĂ©matode Heligmosomoides polygyrus peut empĂŞcher les mâles d’accĂ©der Ă la dominance comportementale Ă partir d’une certaine charge parasitaire (Freeland 1981).
En ce qui concerne la structure dĂ©mograph ique, Arnold & Lichtenstein (1993) montrent qu’il n’y a pas de diffĂ©rence significative de la charge parasitaire entre mâle et femelle. L’analyse statistique des donnĂ©es de notre Ă©chantillon ne dĂ©tecte pas de diffĂ©rence entre les sexes, ni pour la prĂ©valence ni pour l’abondance et l’intensitĂ© moyenne.
Ce sont ici les dimensions immunitaires et personnelles des individus-hĂ´tes qui sont susceptibles de favoriser ou non l’agrĂ©gation. L’immunitĂ©, sous l’influence des caractères gĂ©nĂ©tiques, conduit Ă rendre les individus rĂ©sistant aux parasites de façon très inĂ©gale. Le phĂ©notype de chaque individu, et donc sa capacitĂ© Ă rĂ©sister ou non aux parasites, est sous l’influence de l’histoire de vie, prĂ©sente ou passĂ©e, de chaque animal (Anderson & May 1978). Ainsi il a Ă©tĂ© montrĂ© que les communautĂ©s de parasites se modifient qualitativement et quantitativement au cours de la vie des individus-hĂ´tes, en particulier chez une espèce de poisson mĂ©diterranĂ©en (Saad-Fares & Combes 1992). Cet exemple est certes Ă©loignĂ© de celui de la marmotte et notre Ă©chantillon n’a pas permis de mettre en Ă©vidence une relation entre l’âge des hĂ´tes et la richesse spĂ©cifique ou la charge parasitaire. IndĂ©pendamment de l’âge, tout Ă©vĂ©nement, susceptible d’affaiblir l’hĂ´te, peut favoriser l’infestation.
Chez la marmotte alpine, un Ă©vĂ©nement de cette nature intervient au moins une fois dans la vie des hĂ´tes : la dispersion. Les individus subadultes sont soit chassĂ©s de leur territoire d’origine, soit chassent eux-mĂŞmes le dominant du mĂŞme sexe de leur groupe d’origine pour prendre sa place, soit partent d’eux-mĂŞmes chercher une place de dominant dans un autre groupe. Ces diffĂ©rentes stratĂ©gies sont Ă©tudiĂ©es au niveau comportemental (Magnolon et al. 1997), mais le parasitisme peut aussi participer Ă leur dĂ©terminisme. Holekamp (1986), chez une espèce d’Ă©cureuil, et Van Vuren (1996), chez la marmotte Ă ventre jaune, ont Ă©mis l’hypothèse que les individus se dispersent si le risque parasitaire est Ă©levĂ©, se coupant ainsi du contact social. Ce dernier a en effet montrĂ© que la charge en ectoparasites a tendance Ă ĂŞtre plus Ă©levĂ©e chez les marmottes qui sont en pĂ©riode de dispersion que chez les autres, bien que l’auteur prĂ©cise que la diffĂ©rence n’est pas statistiquement significative.
Le stress et la nutrition peuvent aussi participer Ă la crĂ©ation d’une dispersion plus ou moins forte des parasites entre les hĂ´tes.
Notre Ă©chantillon est Ă©videmment de taille insuffisante pour aborder l’influence de ces divers facteurs. La complexitĂ© des structures de populations de marmottes laisse penser que l’influence respective des diffĂ©rents facteurs sur l’agrĂ©gation observĂ©e ne pourrait ĂŞtre mise en Ă©vidence que grâce Ă une Ă©tude pluridisciplinaire, en Ă©thologie et parasitologie. Or la rĂ©alisation des bilans parasitaires indispensables nĂ©cessite de sacrifier des individus dans les groupes sociaux Ă©tudiĂ©s, ce qui perturbe l’organisation sociale de ceux-ci et rend les observations Ă©thologiques inopĂ©rantes.
3.2, ConsĂ©quences de l’agrĂ©gation
Anderson (1978) a Ă©tabli que : les patrons agrĂ©gĂ©s ou sur-dispersĂ©s du nombre de parasites par hĂ´tes, largement observĂ©s dans les habitats naturels, agissent en augmentant la rĂ©gulation densitĂ©-dĂ©pendante Ă la fois des populations hĂ´tes et parasites. Anderson & Gordon (1982) prĂ©cisent que " c’est dans les quelques hĂ´tes porteurs de la majoritĂ© des parasites que les processus densitĂ©-dĂ©pendants exercent leur influence rĂ©gulatrice, soit via la suppression de la fĂ©conditĂ© ou de la survie parasitaire, soit via l’influence du parasite sur la survie et la fĂ©conditĂ© de l’hĂ´te ".
La rĂ©gulation est un mĂ©canisme de dynamique de population, qui s’applique partout, dès l’instant oĂą le milieu dans lequel vit la population abrite des ressources inĂ©vitablement limitĂ©es (Barbault 1997). L’hĂ´te du parasite est nĂ©cessairement un milieu limitĂ© et seul un processus de rĂ©gulation s’oppose Ă l’accumulation a priori illimitĂ©e d’individus-parasites par recrutement dans le milieu extĂ©rieur.
Combes (1995) dĂ©finit la rĂ©gulation comme : " le maintien d’une population Ă un effectif infĂ©rieur Ă sa capacitĂ© de croissance thĂ©orique, par des mĂ©canismes densitĂ©-dĂ©pendants ". Elle se manifeste dans une population Ă partir d’un certain seuil, Ă©videmment variable suivant le parasite et l’hĂ´te en cause. Les modèles rĂ©alisĂ©s pour dĂ©crire les relations entre populations-parasites et populations-hĂ´tes (Crofton 1971a et 1971b, Anderson & May 1978, May & Anderson 1978) montrent que la rĂ©gulation de la population—hĂ´te par un parasite nĂ©cessite, soit l’agrĂ©gation de la distribution des parasites, soit une augmentation de l’effet pathogène plus rapide que l’augmentation de la charge parasitaire.
3.2.1. RĂ©gulation des populations—hĂ´tes par les parasites :
A l’Ă©chelle des individus, le parasite est, par dĂ©finition, considĂ©rĂ© comme dĂ©favorable, responsable de la maladie, voire de la mort de son hĂ´te. Par contre, Ă l’Ă©chelle d’une population ou d’une espèce, le mĂŞme parasite peut en permettre la survie. Par exemple l’effet pathogène du parasite (au sens large, incluant virus et bactĂ©ries) participe Ă la rĂ©gulation d’une population trop dense, oĂą la compĂ©tition, spatiale ou alimentaire, devient trop forte, en crĂ©ant une dĂ©croissance brusque du nombre d’individus (Holmes 1982). Mais le parasite peut agir de façon moins visible : Ă©tant en compĂ©tition avec son hĂ´te pour ses ressources, en particulier alimentaires dans le cas d’un parasite du tractus digestif, il peut en affecter la fĂ©conditĂ© et la survie, mĂŞme si aucune pathologie n’est visible. L’influence du parasite peut se noyer dans le bruit de fond de tous les autres facteurs qui affectent la fĂ©conditĂ© et la survie de l’hĂ´te (Combes 1995) et est souvent difficile Ă mettre en Ă©vidence, surtout pour les macroparasites. Pourtant, en conditions semi-naturelles, la survie des individus de l’espèce Apodemus sylvaticus parasitĂ©s par le nĂ©matode Heligmosomoides polygyrus est infĂ©rieure Ă celle des individus sains (Gregory 1991).
Il ressort des études, concernant les helminthes en particulier, que les effets régulateurs des populations-parasites sur les populations-hôtes deviennent visibles quand les hôtes sont soumis à des parasites auxquels ils ne sont pas préparés et/ou quand la compétition alimentaire devient telle que les individus-hôtes sont affaiblis par la malnutrition (Gulland 1992).
Chez la marmotte alpine, nous avons recherchĂ© un effet rĂ©gulateur de l’infestation parasitaire sur le site de la Grande Sassière, en particulier sur l’accroissement pondĂ©ral des individus au cours de la saison, sans succès du fait de l’insuffisance de captures en automne. La difficultĂ© Ă mettre en Ă©vidence une telle relation tient au fait que l’augmentation de poids des marmottes est un processus plurifactoriel, et que, sur le site d’Ă©tude, les sources de nourriture des marmottes sont suffisamment abondantes et de bonne qualitĂ© pour Ă©viter la compĂ©tition alimentaire et que les marmottes sont bien "habituĂ©es" Ă leurs parasites.
Â
3.2.2. RĂ©gulation des populations-parasites par les hĂ´tes :
Une infrapopulation parasite ne s’accroĂ®t pas indĂ©finiment dans son individu-hĂ´te. Un processus rĂ©gulateur intervient donc sur l’infrapopulation, Ă la fois de la part des autres parasites prĂ©sents et de la part de l’hĂ´te. La rĂ©gulation par l’interaction des parasites entre eux fait intervenir les processus de compĂ©tition, intra- et interspĂ©cifique que nous envisagerons dans la discussion suivante.
Nous avons vu que le niveau moyen d’infestation parasitaire (prĂ©valence et abondance) de la marmotte est très Ă©levĂ© et variable suivant les espèces parasites. Les mĂ©canismes dĂ©veloppĂ©s par l’hĂ´te dĂ©finitif pour limiter l’infestation parasitaire sont d’origine immunitaire (Grundmann et al. 1976 ; Anderson& May 1978) et la sĂ©vĂ©ritĂ© de la rĂ©ponse immunologique par l’hĂ´te est liĂ©e au niveau de stimulation antigĂ©nique reçue, c’est-Ă -dire au nombre de parasites prĂ©sents dans l’infracommunautĂ©. Anderson & Michel (1977) ont Ă©tabli pour Ostertagia ostertagi que, une telle rĂ©ponse, d’origine humorale ou cellulaire, tend Ă augmenter le taux de mortalitĂ© dans la population parasite et/ou Ă rĂ©duire son potentiel reproductif. Chez la souris Ă pattes blanches (Peromyscus maniculatuss), un seul gène autosomal contrĂ´le le dĂ©veloppement de l’immunitĂ© contre le cestode Hymenolepis citelli. (Wassom et al. (1974)
L’Ă©tude des processus immunitaires mis en œuvre par les marmottes pour contrĂ´ler leur infestation parasitaire demande des investigations que nous n’avons pas rĂ©alisĂ©es dans cette Ă©tude. La nature et l’efficacitĂ© des mĂ©canismes en cause sont probablement très diffĂ©rentes suivant l’espèce parasite, comme en tĂ©moignent les fortes variations d’abondances : l’immunitĂ© mise en œuvre contre Ctenotaenia marmotae serait-elle moins efficace que celle destinĂ©e Ă Citellina alpina, l’abondance du second Ă©tant, en fin de saison, nettement moins forte que celle du premier ?
Â
4. Conclusion
Les infracommunautĂ©s d’helminthes parasites de la marmotte alpine sont structurĂ©es et prĂ©dictibles dans le sens oĂą elles semblent ĂŞtre le rĂ©sultat de processus complexes qui ne doivent que peu de chose au hasard et oĂą leur organisation n’est pas diffĂ©rente d’une annĂ©e Ă l’autre.
Le comportement de la marmotte, son organisation sociale et spatiale jouent des rôles très importants dans la création des patrons agrégés de distribution des infrapopulations.
Le mode de transmission des parasites, contagieux ou transmissibles, favorise et entretient cette agrégation.
Les consĂ©quences de la distribution agrĂ©gĂ©e des parasites sont difficiles Ă mettre en Ă©vidence car, en l’absence de pathologie visible, les effets du parasitisme sur la survie et la fĂ©conditĂ© de l’hĂ´te sont difficiles Ă distinguer des autres facteurs qui les affectent.
La marmotte semble donc être un "habitat de bonne qualité" pour ses helminthes parasites, qui, eux, sont capables de "tirer partie" de ses particularités comportementales.
Â
Â
Â
Bibliographie
Anderson R.M. & May R.M. 1978. Regulation and stability of host-parasite population interactions. I. regulatory processes. Journal of Animal Ecology, 47: 219-247.
Anderson R.M. & May R.M. 1979. Population biology of infectious diseases : Part I. Nature, 280 361-367.
Anderson R.M. & Gordon D.M. 1982. Processes influencing the distribution of parasite numbers within host populations with special emphasis on parasite-induced host mortalities. Parasitology, 85: 373-398.
Arnold W. & Lichtenstein A.V. 1993. Ectoparasite loads decrease the fitness of alpine marmot (Marmota marmota) but are not a cost of sociality. Behavioral Ecology, 41:36-39.
Bassano B., Sabatuer B., Rossi L. & Macchi E. 1992. Parasitic fauna of the digestive tract of Marmota marmota in the western alps. In First International Symposium on Alpine Marmot (Marmota marmota) and genus Marmota, Bassano B., Durio P., Gallo Orsi U. & Macchi E., 13-24.
Blower S.M. & Roughgarden J. 1989. Parasites detects host spatial pattern and density : a field experimental analysis. Oecologia, 78: 138-141.
Bush A.O., Heard R.W.J. & Overstreet R.M. 1993. Intermediate hosts as source communities. Canad Journal of Zoology, 71: 1358-1363.
Combes C. 1995. Interactions durables : Ecologie et évolution du parasitisme. Masson, Paris, 524 p.
Cote I.M. & Poulin R. 1995. Parasitism and group size in social animals: a meta-analysis. Behav. Ecol., 6: 159-165.
Crofton H.D. 1971a. A quantitative approach to parasitism. Parasitoloy 62: 179-193.
Crofton H.D. 1971b. A model of host-parasite relationships. Parasitoloy, 63: 343-364.
Dobson A.P. 1985. The population dynamics of competition between parasites. Parasitology., 91: 317-347.
Dobson A.P. & Hudson P.J. 1992. Regulation and stability of free-living host-parasite system : Trichostrongylus tenuis in red grose. II Population models. Journal of Animal Ecology, 61: 487-498.
Ebermann E. 1976. Oribatids as intermediate hosts of Ctenotaenia marmotae (Frölich, 1802), a tapeworm parasitic in marmots. Zeitschrift fur Parasitenkunde, 50 (3): 303-312.
Euzeby J. 1966. Les maladies vermineuses des animaux domestiques et leurs incidences sur la pathologie humaine. In Maladies dues aux Plathelminthes, tome II, Vigot frères ed., Paris, 663 p.
Fromont E. 1997. Analyse comparative de la transmission de cinq virus dans des populations de chats domestiques (Felis catus L.). Thèse Doc. Université, Lyon, 139 p.
Frontier S. & Pichon-Viale 1998. Ecosystèmes, structures, fonctionnement, évolution. Masson ed., Paris, 447 p.
Grosholz E.D. 1993. The influence of habitat heterogeneity on host-pathogen population dynamics. Oecologia, 96: 347-353.
Hair J.D. 1975. The structure of the intestinal helminths communities of lesser scaup (Aythya affinis). Alberta Univ.
Holekamp K.E. 1986. Proximal causes of natal dispersal in Belding’s ground squirrel (Spermophilus beldingi). Ecol. Monogr., 56: 365-391.
Holmes J.C. & Bethel W.M. 1972. Modification of intermediate host behavior by parasites. In Behavioral aspects of parasite transmission, vol. 51 (suppl.1), J. of the Zoological Linnean Society, Canning & Wright eds., 123-149.
Keymer A.E. & Anderson R.M. 1992. The dynamics of infection of Tribolium confusum by Hymenolepis diminua : the influence of infective-stage density and spatial distribution. Parasitology, 79: 195-207.
Lorenz M.O. 1905. Methods for measuring the concentration of wealth. American Statistical Association, 9: 209-219.
Magnolon S ;, AllainĂ© D. & Coulon J. 1997. A study of the proximal factors affecting natal dispersal in the alpine marmot (Marmota marmota). In Holarctic marmots as a factor of biodiversity, Rumiantsev V.Yu., Nikol’ski A.A., Brandler O.V., Moscow, 166.
Manfredi M.T., Zanin E. & Rizzoli A.P. 1992. Helminth community on Alpine marmots. In First International symposium on Alpine marmot (Marmota marmota) and genus Marmota, Bassano B. et al. eds ., 203-207.
May R.M. & Anderson R.M. 1978. Regulation and stability of host-parasite interactions. II. Destabilizing processes. Journal of Animal Ecology, 47: 249-267.
Pennycuick L. 1971. Frequency distributions of parasites in a popualtion of three-spined stickelbacks, Gasterosteus aculeatus L., with particular reference to the negative binomial distribution. Parasitology, 63: 389-406.
Poulin R. 1993. The disparity between observed and uniform distribution : a new look at parasite aggregation. Intern. J. Parasitol., 26(7): 937-944.
Poulin R. 1995. Misconceptions about the measurement of aggregation : a reply to Ploeger. Intern. J. Parasitol.,, 25(7): 863-864.
Preleuthner M., Prosl H., Bregmann A., & Pinsker W. 1996. Infestation by endoparasites in different Austrian populations of Marmota marmota. In Biodiversity in Marmots, Le Berre M., Ramousse R. & Le Guelte L. eds., 111-112.
Read C.P. 1951. The " crowding effect " in tapeworm infections. The Journal of Parasitology, 37: 174-178.
Rhode K. 1994. Niche restriction in parasites : proximate and ultimate causes. Parasitology, 109: S69-S84.
Saad-Fares A. & Combes C. 1992. Abundance/host size relationship in a fish trematode comminity. Journal of Helminthology, 66: 187-192.
Sabatier B. 1989. Les parasites de la marmotte alpine : étude dans les Alpes françaises et synthèse bibliographique. Thèse de Doctorat Vétérinaire, 178 p.
Scherrer B. 1984. Biostatisque. GaĂŞtan Morin, Quebec, 850 p.
Shaw D.J. & Dobson A.P. 1995 Patterns of macroparasite abundance and aggregation in wildlife populations : a quantitative review. Parasitology, 111: S111-S113..
Scott M.E. 1997. Temporal changes in aggregation : a laboraory study. Parasitology, 94: 583-595.
Thompson S.N. & Kavaliers M. 1994. Phsyiological bases for parasite-induced alterations of host behaviour. Parasitology, 109: S119-S138.
Van Vuren D. 1996. Ectoparasites, fitness and social behavior of yellow-bellied marmots. Ethology, 102: 686-694.